コモンマーモセットのゲノム編集
佐々木 えりか
・(公財) 実験動物中央研究所 マーモセット研究部 部長
・慶應義塾大学 先導研究センター 特任教授
今を遡ること7年前の2009年、小型霊長類のコモンマーモセット(以下マーモセット)の胚にレンチウイルスベクターを用いてGFP遺伝子を導入し、緑色に光るトランスジェニックマーモセットを作製したことを本誌に寄稿させていただいた[1]。
遺伝子改変マウスでは、標的遺伝子ノックアウト技術により有用なモデルが最も多く作製されており、マーモセットでも標的遺伝子ノックアウトモデルの作製が必要と考えられた。しかしながら標的遺伝子ノックアウト技術によるモデル作製には、生殖細胞系列キメラが作製可能な胚性幹(ES)細胞が必要であるが、マウス、ラット以外の動物では、キメラ形成能を持つES細胞が樹立されていないため、標的遺伝子ノックアウトモデルの作製ができなかった。それがゲノム編集技術の登場によって、キメラ形成能を持つES細胞がない生物でも標的遺伝子ノックアウトモデルの作製が可能になった。 |
マーモセットの実験動物としての有用性と特徴については、前稿をご参照いただきたい[1]。我々の研究室では、遺伝子改変技術を用いたヒト疾患モデルマーモセット作製技術の開発を行なっており、トランスジェニックマーモセット作製技術を確立した後、標的遺伝子ノックアウトマーモセット作製に向けて様々な研究を継続していたが、なかなか結果に直結する成果が得られていなかった。そこで、ゲノム編集技術が哺乳類の受精卵でも有用である事が報告された直後より、マーモセット受精卵のゲノム編集により標的遺伝子ノックアウトモデル作製に向けた検討を開始した。
我々は、マーモセットゲノム編集技術の開発のためInterleukin 2 receptor common γ chain (IL2rg)遺伝子をターゲット遺伝子として選択した。その理由として、IL2rg遺伝子は、X染色体上にあり、片アレルのみのノックアウトでもオスでは免疫不全となること、免疫不全マーモセットが作製されれば、再生医療、血液学、腫瘍学、移植免疫学など様々な研究領域のモデルとなり得ること、出生時から免疫不全となるためゲノム編集がマーモセットで有効どうかが早期に明らかにできるからである。
ライフサイクルが長い霊長類では、ファウンダー世代で目的の表現型を示し、改変遺伝子が次世代に伝達することが望まれる。そこで我々は、単に標的遺伝子をノックアウトするだけではなく、改変遺伝子が個体の体内で均一になるようにモザイク状態がない状態の個体を作製することを目指した。産まれた個体の改変遺伝子がモザイクとなって野生型の遺伝子が残存すると目的の表現型がファウンダー世代∗ 1 では示されなくなる可能性が高いためである。
-----------------------------------------------------------------------
∗ 1 ファウンダー世代 : 受精卵に遺伝子を注入し、仮親に導入して生まれた子供の世代。F1はファウンダー個体から生まれた子供。
|
また霊長類の動物実験では、より動物生命倫理に配慮する必要があり、できるだけ目的の遺伝子改変に失敗した動物を作製しないことが重要な課題となる。
そこで我々は、繊維芽細胞を用いて最も切断効率の良い人工ヌクレアーゼを選択し、更にマーモセット受精卵を用いてin vitro でゲノム編集によるノックアウト動物の獲得率および得られる個体のモザイク率を予想する方法を確立した(図 1)。この方法で予想される効率は、実際の個体作出率、個体のモザイク率とほぼ相関する、もしくは実際の成功率の方が若干高い事が示された。また、現在このスクリーニング法により、別の遺伝子のノックアウトにも成功していることから、本方法は霊長類のゲノム編集を行なう際に有用であると考えている。 |
|
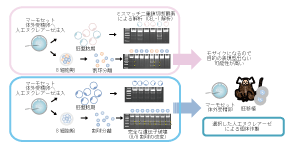
図 1.標的遺伝子ノックアウトマーモセットの作製における人工ヌクレアーゼの評価法
標的遺伝子ノックアウトマーモセットの作製に、最も重要なのはin vitroにおけるモザイクになりにくい人工ヌクレアーゼをスクリーニングすることである。上段:マーモセットの受精卵へ人工ヌクレアーゼを注入して胚盤胞期まで培養し、遺伝子改変を調べると5個中2個に遺伝子改変が認められており、ノックアウト個体の作出効率は、40%と予想される(上)。また同様に人工ヌクレアーゼを注入した受精卵を8細胞期まで培養し、割球を1つずつ分離し、それぞれについてCEL-1解析を行なうと、8割球中3割球に改変が認められ、モザイクとなっていることが予想される(下)。下段:上段と同様の解析により、全ての受精卵で改変が認められ(上)、また全ての割球で標的遺伝子の改変が認められ、モザイクにならないことが予想される(下)。このような人工ヌクレアーゼを選択することにより、ファウンダー世代で目的の表現型を示す標的遺伝子ノックアウト個体が得られると期待される。 |
|
今回我々は、IL2rg遺伝子をターゲットとした人工ヌクレアーゼであるeHiFi-ZFNおよびplatinum TALENを1細胞期のマーモセット体外受精卵に注入することにより、個体の全ての細胞が同一の改変遺伝子配列を持つIL2rg遺伝子ノックアウトマーモセットを作製した(図 2)[2]。これらの個体の臍帯血では、T細胞とNK細胞が欠失していること、一方B細胞数は正常でありヒトのX-SCID∗ 2の患者と類似していること(マウスではB細胞も著減する)、死亡した個体の剖検の結果、胸腺が認められないことから免疫不全マーモセットであることが示された。当初、これらの個体の長期飼育は困難であったが、帝王切開時の麻酔、生後直後の酸素濃度、などの改善により2年以上の長期飼育が可能となった。性成熟に至ったオスの個体の精子を調べたところ、精子でも体細胞と同一の改変された遺伝子配列が認められ、ライン化の可能性も示された。
-----------------------------------------------------------------------
∗ 2 X-SCID:X染色体連鎖重症複合免疫不全症
|
一方で、成体になったこれらの個体では、出生時には認められなかったT細胞が出現し、B細胞が欠失する事が明らかになった。これら増加したT細胞では、IL2rgが機能しないことは確認されており、生後のT細胞の増殖にはIL2rgが関与しないシグナル伝達機構の存在が示唆されている。同様の現象は、一部のヒトのX-SCIDの患者でも報告されている。生後のT細胞の増殖の新たなシグナル伝達機構の解明は、今後の興味深い研究テーマであり、IL2rgノックアウトマーモセットがモデルとして有用となると考えている。 |
|

図 2. ゲノム編集によって作製されたIL2rgノックアウトマーモセット
IL2rgノックアウトによって免疫不全マーモセットが作製された。飼育に関する様々な条件を改善することで長期飼育が可能となった。(佐藤賢哉撮影) |
|