魚の胚発生における増殖と分化のパターンが生きたまま丸見え
−ゼブラフィッシュで機能する蛍光性細胞周期の可視化プローブzFucciの開発−
−ゼブラフィッシュで機能する蛍光性細胞周期の可視化プローブzFucciの開発−
 背景
背景一般的に真核生物細胞では、DNA複製の進行にかかわるタンパク質の「Cdt1」と「Geminin」が、細胞周期進行に伴って活性化されるユビキチンリガーゼ-プロテアソーム系※4によって交互に分解されます。Gemininは、細胞周期のG1期に活性が高いユビキチンリガーゼのAPCCdh1によって分解され、G1期以外の細胞周期(S/G2/M期)で蓄積します。一方、Cdt1は、S/G2/M期に活性が高まるユビキチンリガーゼのSCFSkp2とCUL4Ddb1によって分解され、S/G2/M期以外の細胞周期(G1期)で蓄積します。ほ乳類における細胞周期の進行を可視化するために、研究チームは、ヒトGemininとヒトCdt1から、それぞれAPCCdh1結合部位およびSCFSkp2結合部位を取り出して、異なる色の蛍光タンパク質で標識化した蛍光プローブ「Fucci」を開発しました(2008年2月8日プレス発表)。このFucciを全身に発現する形質転換マウスを作製したところ、体中の細胞の核が細胞周期に従ってオレンジ色(G1期)あるいは緑色(S/G2/M期)に染まることを確認しました。
2008年のFucciの発表後、この技術をマウス以外の実験動物にも応用することが求められてきました。特に、胚発生における細胞周期進行の時空間パターンを個体丸ごと解析するために、遺伝学アプローチが適用可能な魚や昆虫などの実験動物を使って、Fucciを発現する個体を作製することが期待されていました。このため、研究チームは、まずFucciを全身に発現する形質転換魚類動物(ゼブラフィッシュ)の作製を試みました。ところがゼブラフィッシュ細胞では、ヒトGemininのAPCCdh1結合部位はユビキチン修飾による適切な分解制御を受けるにもかかわらず、ヒトCdt1のSCFSkp2結合部位はユビキチンリガーゼで分解されないことが判明しました。これにより、細胞周期依存的ユビキチン修飾における酵素(ユビキチンリガーゼ)と基質(Cdt1)の組み合わせが、ヒトやマウスを含むほ乳類動物細胞とそれ以外の動物細胞とで異なることを認識することができました。
 研究手法と成果
研究手法と成果 研究グループは、まず、ゼブラフィッシュのCdt1遺伝子を単離しました。ヒトCdt1と比較したところ、ゼブラフィッシュCdt1は、SCFSkp2認識部位を欠いており、その代わりにN末部分にPIP box と呼ばれるCUL4Ddb1認識部位を持っていることが分かりました。研究グループは、このPIP boxを含むさまざまな断片にオレンジ色蛍光タンパク質mKO2※5をつなぎ、G1期に特異的な蛍光を示すものを探しました。その結果、mKO2-zCdt1(1/190) がG1期プローブとして最も適していることを見いだしました(図1A)。同様に、Geminin遺伝子もゼブラフィッシュから単離し、さまざまな断片に緑色蛍光タンパク質mAG※5をつなぎ、S/G2/M期のプローブとしてmAG-zGeminin(1/100)が最適であることを見いだしました(図1B)。mKO2-zCdt1(1/190)とmAG-zGeminin(1/100)の組み合わせをzFucciと命名しました。zFucciを発現する魚の細胞の核が、G1期にオレンジ色、S/G2/M期に緑色の蛍光を発することを確認しました(図1C,D)。
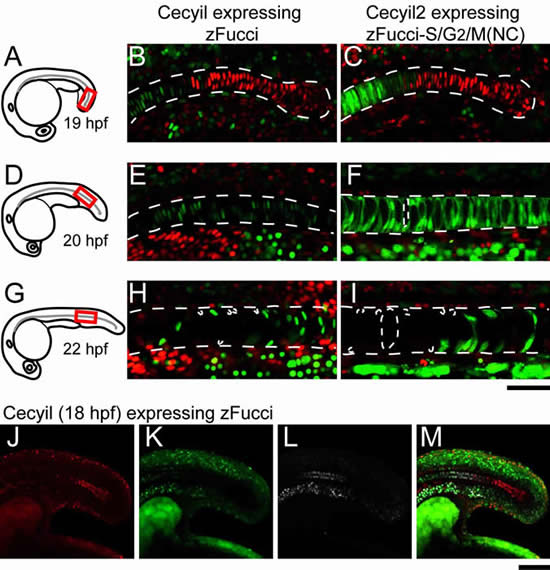
開発したzFucciを用いて、全身に発現するゼブラフィッシュCecyil (Cell cycle illuminated)を作製しました(図2)。Cecyilは、胚発生における増殖と分化を、緑とオレンジの蛍光で色分けすることができます。共焦点レーザー走査顕微鏡※6を用いて蛍光タイムラプスイメージングを行い、高い空間分解能を達成しながらさまざまな器官形成における細胞周期進行を観察しました。その結果、脊索の分化に伴って頭部から尾部へ伝播する2つの細胞周期遷移の波を検出することに初めて成功しました(図3)。すなわち、G1期にある脊索前駆細胞の配列において、頭部から尾部に向かってG1-S遷移が起こり、その後G2期にしばらくとどまった後、頭部から尾部に向かってM-G1遷移が起こり脊索の分化が完了していく様子を詳細にとらえることに成功しました。
 今後の期待
今後の期待 zFucci(プローブ)は、細胞機能探索技術開発チームから、11月16日以降提供します。詳細はホームページに掲載しています。また、形質転換ゼブラフィッシュCecyilは、文部科学省が実施するナショナルバイオリソースプロジェクトのゼブラフィッシュから近く提供を開始します。
zFucciやCecyilを活用して、以下のような研究が可能となります。
以上のような研究計画により、魚の胚発生における増殖と分化との複雑な絡み合いを解きほぐすことができると期待されます。さらに、広く生物種に共通する細胞周期依存的タンパク質分解機構に着目することで、Fucci技術がマウスやゼブラフィッシュ以外の実験動物モデルに応用される可能性が広がります。

A:(上)ヒトCdt (hCdt1)のSCFSkp2結合部位にオレンジ色蛍光タンパク質mKO2を連結したFucciプローブ。
(下)ゼブラフィッシュCdt1 (zCdt1) のCUL4Ddb1結合部位とオレンジ色蛍光タンパク質mKO2との融合タンパク質。mKO2-zCdt1(1/190) が選択された。
B:(上)ヒトGeminin (hGeminin)のAPCCdh1結合部位に緑色蛍光タンパク質mAGを連結したFucciプローブ。
(下)ゼブラフィッシュGeminin (zGeminin) のAPCCdh1結合部位と緑色蛍光タンパク質mAGとの融合タンパク質。mAG-zGeminin(1/100)が選択された。
CとD:zFucci (mKO2-zCdt1(1/190)とmAG-zGeminin(1/100))を発現する魚の細胞の細胞周期プローブとしての性能を、蛍光タイムラプスイメージング(C)とDNA複製染色(D)によって評価。

zFucci形質転換ゼブラフィッシュCecyil (Cell cycle illuminated)の体節形成期を蛍光タイムラプスイメージング。左上の灰色で囲った領域空間(3次元)を経時的に観察。成長とともに、緑色のシグナル(細胞増殖を示す)が減りオレンジ色のシグナル(細胞分化を示す)が増える。観察の後期においても、細胞増殖の盛んな器官(網膜や脳)に緑色のシグナルが検出される。